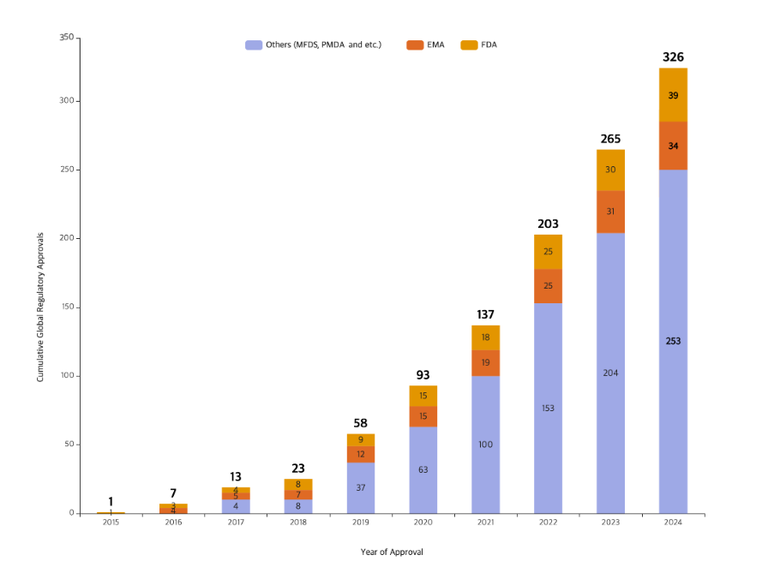
인더뉴스 장승윤 기자ㅣ삼성바이오로직스(대표 존 림)는 2011년 창립한 이후 13년 만에 제품 허가 기준 글로벌 규제기관 제조 승인 건수 300건을 돌파했다고 10일 밝혔습니다.
규제기관 제조 승인은 바이오의약품의 제조 및 관리 전 과정에 대해 GMP(제조·품질관리기준) 및 품질 적합성이 검증됐음을 의미하는 것으로, 위탁생산(CMO) 기업이 생산한 의약품을 시장에 출시하기 위해서는 해당 국가 규제기관의 승인이 필수적입니다.
삼성바이오로직스는 지난 9월 기준 미국 식품의약국(FDA) 39건, 유럽 의약품청(EMA) 34건 등 총 326건의 제조 품목 규제기관 제조 승인을 획득했습니다. 생산능력 확장 및 수주 증가에 따라 해마다 승인 건수를 늘려가고 있습니다. 규제기관 실사 통과율은 업계 최고 수준이라는 설명입니다.
삼성바이오로직스는 설립 직후부터 실사전문팀을 구성해 전문 인력을 양성했습니다. 실사전문팀은 규제기관 및 고객사 실사를 전담하는 팀으로 실사에 필요한 가이드라인을 분석하고 실사 대응 인력을 교육했으며 2015년 약 70명이었던 글로벌 제조 승인 대응 가능 인력을 현재 기준 약 550명까지 늘렸습니다.
또 전자문서 및 전자품질 관리 시스템을 도입해 생산 전반에서 발생하는 다량의 데이터를 의약품 제조 및 품질관리 기준에 맞춰 디지털화하고 실시간 보관 및 열람할 수 있게 했습니다. 이를 통해 동시다발로 요구되는 규제기관의 데이터 검증에도 즉각적이고 빠르게 대응할 수 있게 했습니다.
라이브 버추얼 시스템도 구축해 비대면 실사 역량을 강화했습니다. 모든 공정 과정을 볼 수 있도록 각 기기마다 다양한 앵글의 카메라를 장착한 공장 투어를 구현했으며 실사 현장에는 IT지원 팀을 상시 대기시켰습니다. 코로나19 상황에서도 규제기관 및 고객사 비대면 실사를 184건 이상 진행했습니다.
존 림 삼성바이오로직스 사장은 "글로벌 제약사 제품 수주와 신속한 규제기관 인증 획득을 통해 삼성바이오로직스는 지난 13년 간 CDMO 분야에서 빠르게 성장해왔다"며 "품질경영을 기반한 기술 혁신을 통해 고품질의 바이오의약품을 시장에 적기 공급할 수 있도록 최선의 노력을 다할 것"이라고 말했습니다.
한편 삼성바이오로직스는 현재 시가총액 기준 글로벌 톱 20개 제약사 중 16곳을 고객사로 확보하고 있습니다. 단일 계약 기준 역대 최대 규모인 1조4600억원 규모의 초대형 계약을 비롯해 올해만 총 8건의 신규 및 증액 계약을 체결했습니다. 연 누적 수주 금액 2조6000억원을 돌파했습니다.



















